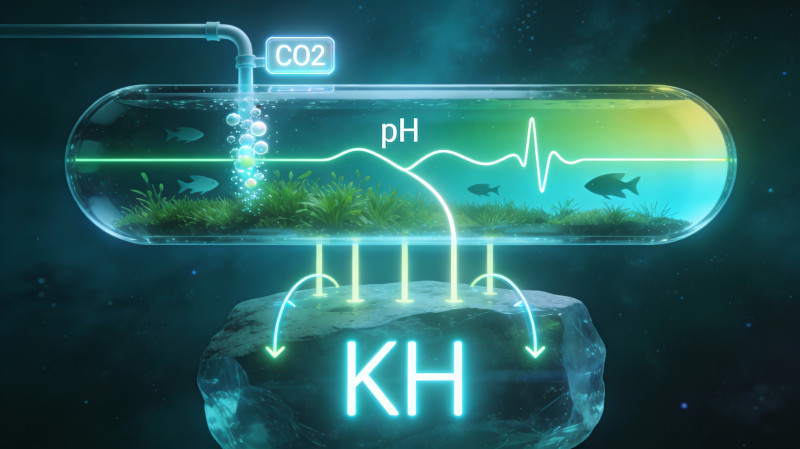
В травнике связка pH-KH-CO₂ определяет не столько "красивые цифры" в тестах, сколько реальную доступность углерода для растений и уровень стресса для рыб. При этом буфер далеко не всегда чисто карбонатный - фосфаты, органика и гуминовые вещества могут серьезно менять поведение системы.
pH, KH и общая буферная емкость
pH - это мера кислотности воды, то есть концентрации ионов водорода H⁺ в растворе. Сам по себе pH не "хороший" и не "плохой" - важны диапазон, стабильность и соответствие типу воды и обитателям.
KH (карбонатная жесткость) отражает содержание гидрокарбонатов и карбонатов, которые обычно играют роль основного буфера в пресной воде и определяют способность системы сопротивляться изменению pH. Но полная буферная емкость (щелочность) включает и другие компоненты - фосфаты, органические кислоты, иногда силикаты - поэтому "KH = весь буфер" верно только в упрощенной модели.
Как CO₂ понижает pH и что при этом делает буфер
Растворяясь в воде, CO₂ образует угольную кислоту, которая отдаёт H⁺ и тем самым понижает pH. Карбонатный буфер реагирует на это, связывая часть "лишней" кислоты за счет перехода гидрокарбонатов и карбонатов в другие формы и сглаживая падение pH.
Если KH низкий (около 0-2 °dKH), буфер слабый, и даже умеренное количество CO₂ может вызвать заметное и довольно резкое снижение pH. При KH порядка 3-6 °dKH падение pH под действием CO₂ становится предсказуемым: обычно на 0,3-1,0 единицы днем по сравнению с утренним значением, что комфортно для большинства рыб при правильной концентрации CO₂.
Некарбонатные буферы: фосфаты и органика
В реальных аквариумах буфер не ограничивается только карбонатной системой.
Вот примеры:
- Фосфатные буферы - их используют многие "фиксирующие pH" препараты, которые задают жесткий диапазон (например, "pH 7,0"), но при этом добавляют в воду значимые количества фосфата. Такая вода может иметь низкий KH и при этом удивительно стабильный pH, а попытки рассчитать CO₂ по классическим таблицам pH-KH дают абсурдные цифры.
- Гуминовые и органические буферы - торф, листья, коряги и специальные препараты с гуминовыми веществами создают мягкую, "черноводную" буферную систему. В мягкой воде это позволяет удерживать pH в слабокислом диапазоне даже при почти нулевом KH, снижая риск резкого "pH crash", но делая связь pH-KH-CO₂ еще менее линейной.
Падение pH при подаче CO₂ в травнике
Типичный сценарий травника: утром, до включения CO₂, растения и бактерии "выедают" CO₂ ночью, и pH встает на более высоком уровне, определенном буфером (карбонатным + некарбонатным). После включения CO₂ концентрация углекислого газа растет, угольная кислота усиливается, pH начинает плавно падать и выходит на рабочее дневное плато.
Нормально, если:
- падение pH происходит в течение 1-3 часов после включения CO₂, а не скачком за 10-15 минут;
- суточная амплитуда в травнике с рыбами не превышает примерно 0,5-1,0 единицы;
- поведение рыб и креветок остается спокойным (нет судорожного дыхания у поверхности, паники в струе фильтра).
Безопасные диапазоны KH и pH в растительном аквариуме
Для большинства пресноводных травников рабочие диапазоны выглядят так:
- KH около 3-6 °dKH - компромисс между стабильностью и гибкостью для CO₂, особенно если некарбонатных буферов немного.
- Утренний pH (без CO₂) часто в зоне 6,8-7,5, днем на CO₂ падает в район 6,2-7,0, в зависимости от исходной воды и дозирования газа.
Почему "идеального" pH не существует
В природе устойчивые растительные биотопы существуют при очень разных pH - от кислых "черных вод" до нейтральных и даже слабощелочных рек и озер. Для рыб и растений критичнее:
стабильность параметров во времени;
- согласованность pH с буферной емкостью, минерализацией и типом буфера;
- отсутствие токсичных форм азота и экстремальных концентраций CO₂.
Как практично работать со связкой pH-KH-CO₂ в травнике
Рациональный подход вместо охоты за "идеальным" pH:
- Определить природу буфера: измерить KH, понимать, используете ли фосфатные буферы, торф, листья, гуминовые препараты.
- Задать умеренный, предсказуемый KH (3-6 °dKH) там, где нужны классические травники с CO₂ и без сильных некарбонатных буферов.
- Настроить подачу CO₂ так, чтобы утренний pH плавно снижался, а дневной уровень CO₂ оставался безопасным для рыб - ориентируясь на поведение обитателей и состояние растений, а не только на таблицы.
- Избегать резких кислотно‑щелочных вмешательств, которые ломают баланс буферной системы и создают "качели" pH, особенно в присутствии аммиака/аммония.
